بينما كان يرمي بعينيه يمنة ويسرة يراقب قائمة العناصر الكيميائية وأوزانها الذرّية، لاحظ شيئا مثيرا للاهتمام، إذ ظهرت بعض الخصائص المتشابهة تتكرر في العناصر على فترات عددية منتظمة، فيظهر نمطٌ معيّن، ولكن سرعان ما يتلاشى. لقد بدا أنّ ثمّة شيئا ما يقف وراء هذه الأحجية الكيميائية، لكن ما هو؟
كان عالم الكيمياء الروسي ديمتري مندلييف على يقين بأنّه يقف على شفا إنجاز عظيم، فلا بد أنّ هناك نمطا غير اعتيادي يربط بين هذه العناصر التي تشكّل كل المادة حوله. لقد كان يوما طويلا حتى شعر بالإعياء إثر فرط التفكير، فاستسلم أخيرا وأراح رأسه الأشعث على ذراعيه ونام، وحينها فقط رأى حُلما قلب الموازين.
لقد كان الحلم الذي غيّر مجرى علم الكيمياء وقلبه رأسا على عقب، وفتح آفاقا جديدة لرؤية العالم من حولنا، ومهّد لاكتشاف المزيد من العناصر الكيميائية بل وحتى التنبؤ بها، وقد كتب مندلييف بنفسه معقبا على الحلم الذي رآه في مذكراته قائلا: “رأيت في المنام طاولة تسقط فيها جميع العناصر في أماكنها الصحيحة كما يجب، وحالما استيقظت كتبت على الفور على ورقة ما قد رأيته”.
لقد اهتدى مندلييف إلى رؤية النمط الصحيح الذي يربط بين العناصر ويجعلها في جدول محكم لترسم الملامح الأولى لما هو عليه الجدول الدوري اليوم، وقد بات هذا الجدول الركيزة الأساسية لدارسي الكيمياء الذي يلخّص علما كاملا في 100 مربع تقريبا تحتوي على رموز وأرقام.
وتوافق بداية شهر مارس/آذار من كل عام ذكرى تأسيس الجدول الدوري الذي غيّر معالم الكيمياء إلى الأبد، وفتح آفاقا جديدة ساهمت في وضع القانون الدوري الذي ينصّ على وجود روابط عائلية وثيقة (مجموعات) بين العناصر الكيميائية المعروفة، فتظهر خصائص متشابهة في كلّ عائلة (مجموعة) على فترات منتظمة عندما تُرتب حسب أوزانها الذريّة.
وكذلك مهّد الجدول الدوري إلى التنبؤ بالمزيد من العناصر الكيميائية التي استعصى على العلماء الوصول إليها بالطريقة التقليدية المباشرة، فيشير مندلييف معقبا أنه قبل اكتشاف القانون الدوري، كانت العناصر الكيميائية مجرّد حقائق عرضية موجودة في الطبيعية.

تمهيد.. ما قبل حلم مندلييف
بعد مضي نحو 155 عاما على حُلمه الشهير، تقول الأسطورة إن مندلييف تمّكن من إنشاء الجدول الدوري في يوم واحد، في 1 مارس/آذار 1869 على وجه التحديد. ولكن في الحقيقة، كان هذا الجدول محصلة عمل سنوات عديدة، كما أن مساهمات الكيميائيين الآخرين في العقود الماضية لا يمكن التغاضي عنها بأي شكل.
وما تذكره السجلات أنّ الكيميائي الألماني يوهان دوبرينر كان من السبّاقين لإدراك تلك الخصائص المشتركة في مجموعات العناصر الكيميائية في عام 1817، إلا أنه في ذلك الحين لم يكن الكيميائيون على اطلاع وفهم جيّد بعد لطبيعة الذرة، وذلك بعد محاولة العالم الإنجليزي جون دالتون في عام 1808 لوضع النظرية الذرية وشرحها للمجتمع العلمي آنذاك.
اقترح دالتون أن التفاعلات الكيميائية تحدث عندما تنفصل الذرات أو تندمج، مما يؤدي إلى تكوين مواد جديدة، واقترح أن كل عنصر يتكون بالكامل من نوع واحد من الذرات يتميز عن غيره بوزنه. فعلى سبيل المثال وزن الأكسجين ثمانية أضعاف وزن ذرات الهيدورجين، وكان دالتون يعتقد أنّ ذرات الكربون أثقل بستة أضعاف من الهيدورجين. وعندما تتحد هذه العناصر لتكوين مواد جديدة، يمكن حساب الكميات التي تفاعلت بمعرفة الأوزان الذرية.
ولعلّ دالتون كان مخطئا حيال بعض الأوزان، فالأكسجين يفوق وزن الهيدروجين بـ16 مرّة، والكربون أثقل من الهيدروحين بـ12 مرّة. وعلى أيّ حال، كانت المداخل الأولى للنظرية الذرية دافعا مهما للكيميائيين في العقود التالية للتدقيق أكثر على الأوزان الذرية. فقد لاحظ دوبرينر أنّ مجموعات معيّنة من العناصر الثلاثة -التي أطلق عليها اسم الثلاثيات- تمتلك علاقة مثيرة للاهتمام. فعلى سبيل المثال كان لعنصر البروم وزن ذرّي يقع في المنتصف بين وزني الكلور واليود، وتُظهر هذه العناصر الثلاثة سلوكا كيميائيا مماثلا، وكذا الأمر بالنسبة لعناصر الليثيوم والصوديوم والبوتاسيوم أيضا.
لقد أدرك الكيميائيون الآخرون وجود روابط وثيقة بين الأوزان الذرية والخصائص الكيميائية، ولكن بسبب فشل التقنيات ومحدوديتها آنذاك لم يكن بمقدروهم قياس الأوزان الذرية للعناصر بالشكل الكافي.
وحتى ستينيات القرن التاسع عشر، لمعت أسماء مميزة في سماء أوروبا، ففي إنجلترا لاحظ الكيميائي جون نيولاندز أنّ ترتيب العناصر المعروفة -والتي بلغت 56 عنصرا آنذلك- يمكن تحقيقه إلى 8 مجموعات، ويُطلق عليها “ثمانيات نيولاندز”.
ومع وجود حلقات مفقودة لم يصمد الترتيب السابق طويلا، وهو ما دفع مندلييف لاحقا إلى الإدراك بأنّ العلاقة بين خصائص العناصر والأوزان الذرية كانت أكثر تعقيدا مما كان يعتقد في البداية.

وضع العناصر في نصابها
في بداية رحلته المهنيّة، تنقّل مندلييف حول أوروبا ليعمل في أبرز مختبرات الكيمياء الجامعية قبل أن يستقر وينتهي به المطاف في مدينة سانت بطرسبيرغ غربي روسيا. وقد كان في ذلك الوقت بارعا في الكتابة، لذا ألف كتابا عن الكيمياء العضوية بغية الحصول على جائزة نقدية كبيرة. ثم ما لبث أن عمل محررا ومترجما ومستشارا في العديد من الصناعات الكيميائية، ثمّ أخيرا عاد إلى المجال التعليمي ليحصل على شهادة الدكتوراه ويصبح أستاذا في جامعة سانت بطرسبيرغ العريقة.
وجد مندلييف نفسه في بداية مشواره التعليمي مضطرا لتدريس مجال جديد عليه وهو الكيمياء غير العضوية، لذا رسّخ جلّ وقته لإتقان هذا المجال، لكنّه لم يكن مقتنعا بالمنهاج التعليمي والكتب الجامعية المتوفرة آنذاك. لذلك قرر أن يكتب منهاجا كاملا بنفسه، وهنا كانت الشرارة الأولى؛ فتنظيم النصوص يتطلّب بالضرورة ترتيب العناصر الكيميائية، فكان السؤال الذي لمع في ذهنه: ما هي أفضل طريقة لترتيب هذه العناصر؟
وبحلول 1869 كان مندلييف أحرز تقدما جيدا في إدراك أن بعض مجموعات العناصر المتشابهة تُظهر زيادة منتظمة في الأوزان الذرية، وتشترك العناصر الأخرى ذات الأوزان الذرية المتساوية تقريبا في خصائص مشتركة. فبدا أن ترتيب العناصر حسب وزنها الذري هو المفتاح لتصنيفها.
ووفقا لمندلييف فإنّه بدأ عمله بتنظيم أفكاره من خلال كتابة كل خاصية من خصائص العناصر المعروفة التي وصل عددها آنذاك إلى 63 عنصرا على بطاقات ملاحظات صغيرة. ومن ثمّ بترتيب هذه البطاقات في مصفوفات عامودية وفقا للأوزان الذريّة؛ الأقل فالأعلى، فعمل على جمع العناصر ذات الخصائص المتشابهة في صفوف أفقية. وحينها كان جدول مندلييف قد لاح بالظهور، وسرعان ما أرسله إلى المطبعة وأدرجه في كتابه المقرر نشره، وفي هذه الأثناء بدأ العمل على كتابة ورقة علمية ليقدمها إلى الجمعية الكيميائية الروسية.
وقد جاء في ورقته أنّ العناصر المرتبة حسب أوزانها الذرية تظهر خصائص دورية واضحة، وجميع استنتاجاته تشير إلى أمر واحد وهو أنّ الوزن الذري هو المحدد لطبيعة العناصر وترتيبها.
ومن المفارقات أنّ الكيميائي الألماني لوثر ماير كان يعمل هو الآخر على عمل مشابه وقريب، إلا أنّ مندلييف سبقه في نشر جدوله.
وما يميّز الجدول الدوري الذي جاء به مندلييف أنّه ترك مساحات فارغة لعناصر جديدة غير مكتشفة، وهو ما تحقق فعلا لاحقا. ففي ما تبقى من حياة مندلييف توصّل العلماء إلى اكتشاف 3 عناصر كيميائية جديدة وهي الغاليوم والسكانديوم والغرمانيوم.
وفي الحقيقة لم يتنبأ مندلييف بهذه العناصر فحسب، بل وصف خصائصها بالتفصيل على نحو سليم، فعلى سبيل المثال قال إن الغاليوم الذي اكتُشف عام 1875 يبلغ وزنه الذري 69.9، وهو ما طابق الحسابات التجريبية.
لقد أصبح جدول مندلييف بمثابة الملهم لكافة علماء الكيمياء، فالأمر يشبه لوحة فسيفساء عظيمة تُختزل أسرار الكون بداخلها، وأن كل قطعة باتت في المكان الصحيح حتى قبل العثور عليها. لقد أكسبته تلك التبنؤات الصحيحة والناجحة مكانة أسطورية في الأوساط العلمية.
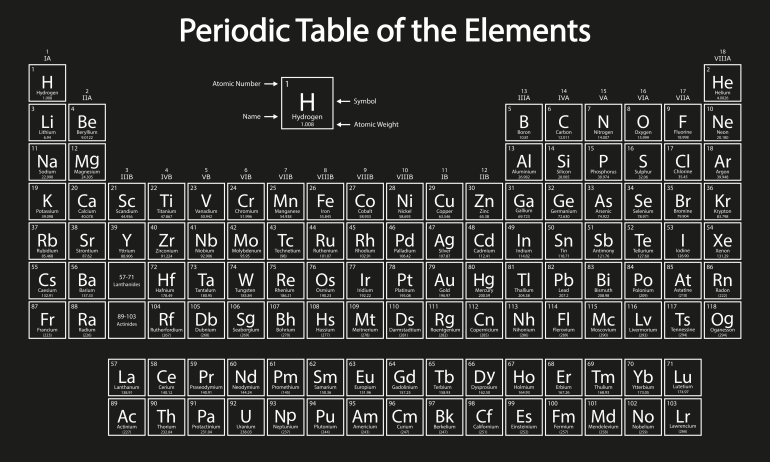
خارطة رياضية عميقة تصف الطبيعة
في المجمل، فإنّ التنبؤات العلمية تنشأ على أساس رياضي وعلى معادلات رياضية محكمة، فعلى سبيل المثال معادلات آينشتاين للنسبية تتنبأ بالثقوب السوداء وانحناء الكون، وهو ما أثبتته التجارب، وأيضا توسّع الكون ووجود المادة المظلمة وغيرها من الحقائق العلمية التي بُنيت على معادلات رياضية قبل اكتشافها والتحقق منها.
ولكن، وعلى نحو مثير، فإنّ ما رمى إليه مندلييف من تنبؤات بالعناصر الكيميائية الجديدة عبر جدوله الدوري لم يكن يعتمد على أيّ معادلات رياضية مبتكرة، بل كان الأمر أعظم من ذلك بكثير. فما توصّل إليه -دون إدراكه- هو رسم خارطة رياضية عميقة للطبيعة، لأنّ جدوله يعكس مضامين قوانين ميكانيكا الكم، والقواعد الرياضية التي تحكم البناء الذري.
وقد ذكر مندلييف أن الاختلافات داخل الذرات نفسها يمكن أن تفسر الخصائص المتكررة للعناصر، ولكنه لم يتحرّ عن ذلك الأمر، واكتفى بالإشارة إلى أهمية النظرية الذرية بالنسبة لجدوله الدوري.
وفي خضم محاولة الكشف عن أسرار الجدول الدوري، وفي عام 1888 على وجه التحديد، توصّل الكيميائي الألماني يوهانس ويسليسنوس إلى حقيقة مثيرة هي أنّ نمط خصائص العناصر المرتبة حسب وزنها الذري يشير إلى أن الذرات تتكون من جزيئات أصغر مرتبة بانتظام. وهذا يعني أنّ جدول مندلييف تنبأ بفكرة البنية الداخلية المعقدة للذرات، وكان ذلك دافعا إضافيا للكيميائيين والفيزيائيين على حد سواء لفهم طبيعة البنية الداخلية للذرة نفسها.
وعند وفاة مندلييف في عام 1907، كان العلماء قد تعرفوا على بعض مكونات الذرة مثل الإلكترونات التي تحمل شحنة كهربائية سالبة، بالإضافة إلى بعض مكون آخر موجب الشحنة لجعل الذرة محايدة كهربائيا.
وجاء الدليل الرئيسي لكيفية ترتيب هذه الأجزاء في عام 1911، عندما اكتشف الفيزيائي إرنست رذرفورد وجود النواة داخل الذرّة. وبعد ذلك بوقت قصير، توصّل الفيزيائي هنري موسلي إلى أنّ كمية الشحنة الموجبة في النواة تحدد الترتيب الصحيح للعناصر في الجدول الدوري، وكمية الشحنة الموجبة في النواة تساوي عدد البروتونات التي تحتوي عليها الذرة أو عددها الذري.
لقد كان الوزن الذرّي على ارتباط وثيق بالعدد الذري الذي اكتُشف مؤخرا لدرجة أن ترتيب العناصر حسب أوزانها الذرية لا يختلف إلا قليلا عن ترتيبها حسب أعدادها الذرية. وكان مندلييف قبل وفاته ألمح إلى أنّ بعض الأوزان الذريّة المستخدمة في ذلك الوقت ليست صحيحة وتحتاج إلى إعادة حسابها، وثبت أنه كان على حق في بعض الحالات. لقد ساهم العدد الذرّي المكتشف في إعادة ترتيب العناصر وتنظيمها في الجدول الدوري بشكل فعّال.
وفي الفترة نفسها تقريبا كان الفيزيائي الدانماركي نيلز بور أدرك أن سلوك الإلكترونات التي تدور حول نواة الذرة تحكمه نظرية الكم، وأدرك أيضا أن الإلكترونات الخارجية الموجودة في الغلاف الخارجي البعيد عن الذرة والمعروفة باسم “إلكترونات التكافؤ”، تلعب دورا حاسما في تحديد الخواص الكيميائية للعنصر. وكانت هذه الرؤية مهمة لأنها ساهمت في فهم التركيب الذري وكيفية تفاعل العناصر مع بعضها البعض كيميائيا.
ولاحظ بور كذلك أنّ الإلكترونات الخارجية للذرات لها ترتيبات مماثلة وتتكرر بشكل دوري، وساعده ذلك على تفسير الأنماط المعيّنة التي كشف عنها الجدول الدوري لمندلييف. وفي عام 1922، طور بور نسخته الخاصة من الجدول الدوري مستندا إلى قياسات تجريبية لطاقات الإلكترونات، بالإضافة إلى اعتماده على بعض الخصائص من القانون الدوري.
وافق جدول بور الدوري ترتيب مندلييف إلى حد كبير، وهو ما يعكس مدى دقة ومطابقة جدول مندلييف الأوّلي لقوانين الكم والفيزياء الذريّة دون حتى أن يكون على اطلاع عليها بشكل مباشر.
لقد كان جدول بور الدوري واحدا من بين العديد من الإصدارات التي أعقبت ترتيب مندلييف الأصلي للجدول الدوري. وعلى مر السنين، طُرِحت عدّة جداول دورية حتى وصل إلى نسخته الأخيرة التي نراها اليوم والتي تتميز بالترتيب الأفقي، على عكس الترتيب الرأسي الأصلي لمندلييف. ويُعزى الترتيب الحالي إلى حد كبير إلى جهود الكيميائي الأميركي جلين سيبورغ الذي لعب دورا مهما في تطويره.
وتضمّنت مساهمة سيبورغ وزملائه إيجاد عدّة عناصر جديدة بأعداد ذرية تفوق العدد الذري لعنصر اليورانيوم، والذي كان آخر عنصر طبيعي معروف في تلك الفترة. ويُطلق على العناصر الجديدة “عناصر ما بعد اليورانيوم”، وتطلّب من سيبورغ إنشاء صف جديد في الجدول الدوري، وهو تطوّر لم يتنبأ به مندلييف من قبل.
أدرج سيبورغ الصف الجديد للعناصر ما بعد اليورانيوم، ووضعها أسفل صف مماثل للعناصر الأرضية النادرة التي تشمل الديسبروسيوم والإربيوم واليوربيوم وغيرها. وفي مقابلة مع سبورغ عام 1997، أشار إلى أنّ الأمر يتطلّب الكثير من الشجاعة والجرأة للقيام بأمر مغاير لجدول مندلييف، على الرغم من تطابق الجدولين في العديد من السمات الأساسية.
وانطلاقا من مساهمات سيبورغ في تطوير الجدول الدوري، كُرّم بتسمية أحد العناصر الجديد المكتشفة على اسمه، وهو عنصر سيبورغيوم، في حين سُمّي عنصر المندليفيوم الذي اكتشفه سيبورغ وزملاؤه في عام 1955، تخليدا للعالم الروسي الذي وضع السمات الأولى للجدول الدوري الذي نراه اليوم.
![]()